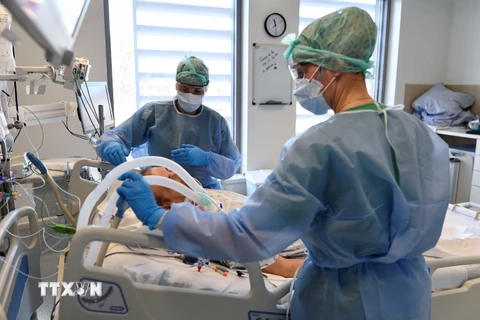
Nhân viên y tế chuyển bệnh nhân COVID-19 tới trung tâm y tế ở New York, Mỹ. (Ảnh: THX/TTXVN)
Nhân viên y tế chuyển bệnh nhân COVID-19 tới trung tâm y tế ở New York, Mỹ. (Ảnh: THX/TTXVN) Ngày 26/1, Cơ quan Quản lý thực phẩm và dược phẩm Mỹ (FDA) đã quyết định điều chỉnh giấy phép sử dụng khẩn cấp (EUA), về việc sử dụng phương pháp điều trị bệnh COVID-19 bằng kháng thể đơn dòng bamlanivimab kết hợp với etesevimab của hãng dược phẩm Eli Lilly và casirivimab kết hợp với imdevimab của công ty công nghệ sinh học Regeneron.
Theo thông báo mới nhất của FDA, các kháng thể đơn dòng trên giờ đây chỉ được sử dụng trong các trường hợp “khi bệnh nhân có khả năng đã bị nhiễm hoặc tiếp xúc với một biến thể mà phương pháp này có thể điều trị được."
Tuyên bố trên được bà Patrizia Cavazzoni, Giám đốc Trung tâm Nghiên cứu và Đánh giá thuốc của FDA đưa ra sau khi phân tích dữ liệu chứng minh rằng các phương pháp điều trị này “rất khó có tác dụng chống lại biến thể Omicron."
Bà nhấn mạnh tầm quan trọng của việc bỏ qua các phương pháp điều trị có khả năng không hiệu quả nhằm tránh để bệnh nhân gặp các tác dụng phụ, chẳng hạn như phản ứng tại chỗ tiêm hoặc dị ứng. Tuy nhiên, FDA không loại trừ hoàn toàn việc sử dụng các kháng thể đơn dòng trong tương lai.
[COVID-19: Mỹ hạn chế sử dụng 2 liệu pháp điều trị kháng thể đơn dòng]
FDA cũng lưu ý rằng mặc dù có giới hạn phạm vi sử dụng của các phương pháp điều trị của Regeneron và Lilly tại thời điểm này, vẫn còn một số lựa chọn loại thuốc điều trị thay thế, bao gồm Paxlovid, sotrovimab, Veklury (remdesivir) và molnupiravir - được cho có khả năng chống lại biến thể Omicron lây lan mạnh.
Tuyên bố của FDA cũng nhấn mạnh rằng mặc dù một số phương pháp nhất định điều trị COVID-19 đã được cấp phép, các nhà cung cấp dịch vụ chăm sóc sức khỏe nên tham khảo hướng dẫn COVID-19 của hội đồng Hướng dẫn điều trị COVID-19 thuộc Viện Y tế quốc gia Mỹ (NIH) để đánh giá liệu bệnh nhân có đủ điều kiện điều trị bằng những phương pháp cụ thể hay không.
Bà Cavazzoni cũng nhấn mạnh rằng những phương pháp điều trị này không thể thay thế việc tiêm vaccine ngừa COVID-19 và mũi tiêm tăng cường vừa an toàn, vừa hiệu quả./.